La Chine a récemment dévoilé sa propre version du système de « patent linkage » constituant ainsi un nouvel écosystème de résolution des litiges en matière de brevets pharmaceutiques avant l’approbation des médicaments génériques. Il s’agit là d’une étape importante pour l’industrie pharmaceutique chinoise, que nous allons analyser.
Cadre juridique du patent linkage
A la date de publication de notre article, les lois et mesures constituant le cadre juridique du système chinois de « patent linkage » sont les suivantes :
- l’article 76 de la loi sur les brevets, introduit lors de la 4ème révision de la loi, entrée en vigueur le 1er juin 2021 ;
- les mesures d’exécution du mécanisme de règlement précoce des différends relatifs aux brevets pharmaceutiques (à l’essai), émises conjointement par la CNIPA et la NMPA (National Medical Product Administration) et entrées en vigueur le 4 juillet 2021 ;
- les mesures administratives pour statuer sur le mécanisme de règlement précoce des différends en matière de brevets pharmaceutiques, émises par la CNIPA et entrées en vigueur le 5 juillet 2021 ;
- les dispositions sur plusieurs questions concernant l’application de la loi dans les procès d’affaires civiles sur les différends en matière de brevets liés aux médicaments faisant l’objet d’une demande d’autorisation de mise sur le marché, émises par la Cour Suprême de la Chine et entrées en vigueur le 5 juillet 2021 ;
- le document de référence concernant les affaires civiles impliquant des litiges en matière de brevets liés à des médicaments dont les demandes d’enregistrement sont déposées (à l’essai) ainsi que son interprétation, publiés par la Cour de la PI de Pékin le 31 décembre 2021.
L’article 76 de la loi sur les brevets prévoit les dispositions suivantes :
Dans le cadre du processus d‘examen et d’approbation de la commercialisation d‘un médicament, si un différend survient entre le demandeur d’une autorisation de mise sur le marché d‘un médicament et le titulaire du brevet concerné ou une partie intéressée en raison du droit de brevet du médicament demandé pour l’enregistrement, les parties concernées peuvent déposer une action en justice auprès du tribunal populaire en lui demandant de statuer sur la question de savoir si la solution technique relative au médicament pour lequel l’enregistrement est demandé tombe dans la portée de protection des brevets de médicaments des tiers. Le département de supervision et de gestion des médicaments du Conseil d’État peut, dans le délai prescrit, prendre une décision sur la suspension de l’approbation de l’enregistrement des médicaments concernés conformément à la décision effective du tribunal populaire.
Les demandeurs d’autorisation de mise sur le marché de médicaments et les titulaires de brevets concernés ou les parties intéressées peuvent également demander des décisions administratives auprès du département d’administration des brevets du Conseil d’État pour les différends concernant les droits de brevet liés aux médicaments pour lesquels l’enregistrement est demandé.
Le département de supervision et de gestion des médicaments du Conseil d’État, en collaboration avec le département d’administration des brevets du Conseil d’État, doit formuler des mesures spécifiques pour lier l’approbation de l’autorisation de commercialisation des médicaments et la résolution des différends relatifs aux droits de brevet au stade de la demande de l’autorisation de commercialisation des médicaments, qui doivent être mises en œuvre après l’approbation du Conseil d’État.
Cet article est perçu comme la version chinoise de la loi « Hatch-Waxman ». Néanmoins, les mesures d’exécution et les mesures administratives confèrent au système des spécificités chinoises, comme nous allons le voir dans cet article.
Pour rappel, selon la loi chinoise sur les brevets, il existe trois types de médicaments, qui sont les médicaments chimiques, les médicaments biologiques et les médicaments traditionnels chinois. Le système de patent linkage a vocation à s’appliquer à tous ces types de médicament, cependant les dispositions relatives aux périodes d’attente et d’exclusivité, qui constituent les bénéfices les plus importants du système, ne sont applicables qu’au médicament chimique. Il est possible que les autres types de médicament fassent l’objet de règles similaires dans le futur, pour le moment le législateur n’a pas fait part de ces intentions sur la question.
En effet, du côté des États-Unis, la loi « Hatch-Waxman » prévoit un système de patent linkage applicable uniquement aux médicaments chimiques, mais ce dernier est complété par le système de « Patent Dance » (mis en place par le Biologics Price Competition and Innovation Act) qui couvre quant à lui les médicaments biologiques et prévoit également une période d’exclusivité, dont la durée est de 12 mois.
Schéma explicatif du système chinois de patent linkage applicable au médicament chimique :
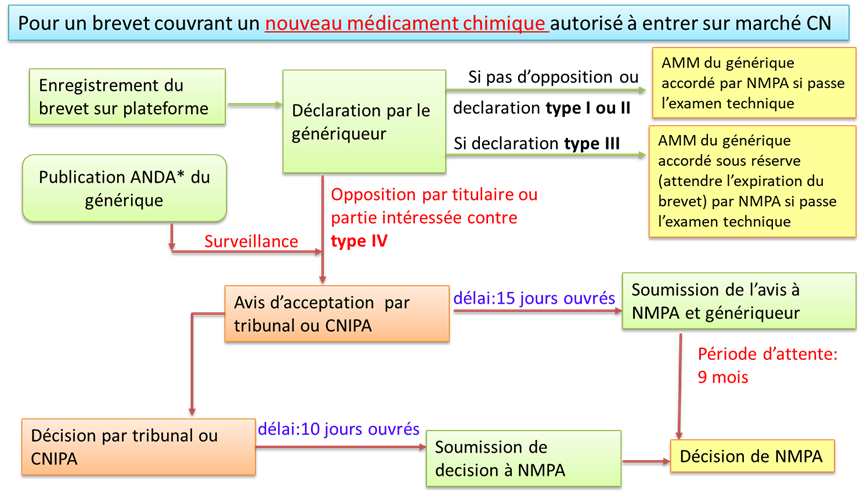 *ANDA: Abbreviated New Drug Application
*ANDA: Abbreviated New Drug Application
Enregistrement des brevets sur la plateforme
Dans le cadre du nouveau régime, la NMPA a mis en place une plateforme chinoise d’enregistrement d’informations sur les brevets liés aux médicaments commercialisés (consultable ici) (ci-après la plateforme). Cette plateforme est ouverte au public et est équivalente à la combinaison de l’Orange Book et du Purple Book aux États-Unis. Les brevets enregistrables sur cette plateforme varient en fonction du type de médicament, comme illustré dans le tableau ci-après :
| Médicament chimique | Médicament biologique | Médicament traditionnel chinois | |
| Brevets enregistrables | (1) Brevet de principe actif (composé)
(2) Brevet de composition comportant le principe actif (3) Brevet d’utilisation (ou d’application) médicale |
(1) Brevet de séquence du principe actif
(2) Brevet d’utilisation (ou d’application) médicale |
(1) Brevet de composition
(2) Brevet d’extrait (3) Brevet d’utilisation (ou d’application) médicale |
Comme il ressort de ce tableau, les brevets sur les méthodes/procédés de préparation/fabrication, intermédiaires, métabolismes, cristallisation, etc., ne sont pas enregistrables sur la plateforme. L’enregistrement d’information de brevet doit être réalisé par le détenteur d’une autorisation de mise sur le marché (AMM ci-après) dans les 30 jours suivant l’obtention du certificat d’enregistrement du médicament.
Déclaration à déposer par un génériqueur
Une entité fabriquant des médicaments génériques (ci-après génériqueur) demandant une AMM pour un médicament générique a l’obligation de consulter la plateforme et de déposer une déclaration vis-à-vis de chacun des brevets pertinents qu’elle a identifiés. Il existe quatre types de déclaration :
- Il n’y a aucun brevet pertinent enregistré sur la plateforme ;
- Le brevet pertinent a déjà expiré, été invalidé ou bien le génériqueur est déjà licencié de ce brevet ;
- Le génériqueur promet de ne pas commercialiser le médicament générique avant l’expiration du brevet pertinent ;
- Le brevet pertinent doit être invalidé (type IV-1), ou le médicament générique n’entre pas dans la portée de protection de ce brevet (type IV-2).
Le génériqueur doit communiquer la déclaration et les documents à l’appui de celle-ci au détenteur de l’AMM du médicament princeps lié au brevet contre lequel la déclaration a été faite. Malgré cette obligation du génériqueur, nous recommandons vivement au titulaire du brevet ou détenteur de l’AMM du médicament princeps de surveiller régulièrement la publication de la demande de l’AMM et de la déclaration du génériqueur afin de pouvoir réagir le plus tôt possible.
Le titulaire du brevet ou les parties intéressées peuvent déposer une opposition contre la déclaration de type IV-2, soit devant la Cour de la Propriété Intellectuelle de Pékin (voie judiciaire), soit devant la CNIPA (voie administrative), en lui demandant de déterminer si la solution technique liée au médicament générique entre dans la portée de protection du brevet. Cette opposition doit être déposée dans un délai de 45 jours à compter de la date de publication de la demande de l’AMM du médicament générique et donc de la déclaration (et non à partir de la date de réception de l’avis de déclaration envoyée par le génériqueur comme aux États-Unis). Par « parties intéressées », on entend les licenciés du brevet ou le détenteur de l’AMM du médicament lié au brevet.
Concernant ce délai de 45 jours, relevons qu’en pratique, les sociétés étrangères qui voudraient déposer une opposition rencontreront des difficultés importantes pour respecter ce délai. En effet, conformément au document de référence de la Cour de PI de Pékin, si le demandeur est une entité étrangère, il doit fournir, au moment du dépôt de l’opposition, les documents requis pour la procédure en version notariée et légalisée. Etant donné les délais nécessaires pour accomplir ces formalités, il y a fort à parier que cette condition constitue un défi de taille pour les entités étrangères. Le document de référence étant en phase d’essai, nous espérons que des ajustements seront effectués pour prendre en compte la situation des entités étrangères. A défaut, celles-ci pourraient être privées de la possibilité de bénéficier de ces dispositions du patent linkage.
Période d’attente (applicable uniquement aux médicaments chimiques)
Si l’opposition est acceptée par la Cour ou la CNIPA, l’opposant doit soumettre l’avis d’acceptation à la NMPA dans un délai de 15 jours ouvrés à compter de la date d’acceptation de l’opposition. Cela a pour effet d’ouvrir une période d’attente de 9 mois (contre 30 mois aux États-Unis) à compter de la date d’acceptation de l’opposition pendant laquelle l’AMM ne sera pas accordée au médicament générique. Pendant cette période, l’examen technique du médicament générique ne s’arrête pas. Cela signifie que le titulaire du brevet ou une partie intéressée a 9 mois pour obtenir une décision effective confirmant « l’entrée dans la portée de protection du brevet », rendue par la Cour ou la CNIPA, afin d’empêcher la mise sur le marché du médicament générique. Bien qu’actuellement la CNIPA et les cours fassent énormément d’efforts pour raccourcir le délai d’examen, il nous semble quasiment impossible d’arriver à une décision effective en si peu de temps. En effet, dans ce type d’affaires, les décisions de première instance sont souvent contestées et la décision de seconde instance est généralement rendue environ 11 mois après le début de la procédure. En tout cas, si une décision effective est finalement rendue par la Cour ou la CNIPA, il faudra la soumettre rapidement à la NMPA pour qu’elle en tienne compte si sa décision sur l’AMM du médicament générique n’est pas encore prise.
Si la décision effective confirme que le médicament générique entre dans la portée de protection du brevet (ci-après « conflit de brevet ») et que cette décision est communiquée à la NMPA pendant la période d’attente de 9 mois, alors la NMPA reportera l’examen administratif de la demande d’AMM du médicament générique jusqu’à peu avant l’expiration du brevet pertinent. C’est la circonstance la plus favorable au titulaire du brevet dans laquelle le médicament innovant peut bénéficier du monopole le plus long du marché chinois. Si, au contraire, la décision infirme le conflit de brevet, si une conciliation a abouti entre les deux parties, si le brevet pertinent est finalement invalidé par le génériqueur, ou si aucune décision effective ni acte de conciliation n’est reçu par la NMPA pendant la période d’attente de 9 mois, alors l’examen administratif de la demande d’AMM du médicament générique sera déclenché dès que possible par la NMPA. Si une décision effective confirmant le conflit de brevet est reçue par la NMPA après l’expiration de la période d’attente de 9 mois et que l’examen administratif de la demande d’AMM du médicament générique n’est pas encore terminé, la NMPA va suspendre l’examen administratif et le reprendra peu avant l’expiration du brevet pertinent.
Période d’exclusivité du marché (applicable uniquement aux médicaments chimiques)
Le premier génériqueur qui a réussi un « patent challenge », c’est-à-dire qui a déposé une déclaration de type IV-1 contre le brevet pertinent, a ensuite réussi à invalider ce brevet et a obtenu l’AMM pour son médicament générique, profite d’une période d’exclusivité du marché de 12 mois (contre 180 jours aux États-Unis) à compter de la date d’obtention de l’AMM. Pendant cette période d’exclusivité du marché, les autres médicaments génériques de même genre ne seront pas autorisés à entrer sur le marché mais l’examen technique de ces derniers ne cesse pas. Bien entendu, cette période d’exclusivité du marché ne doit pas dépasser la durée du brevet invalidé. Grâce à ce régime de stimulation, les génériqueurs seront motivés pour challenger les brevets liés aux médicaments innovants.
Si les différends relatifs aux brevets de médicaments ne peuvent pas être résolus avant la mise sur le marché, ils peuvent toujours être résolus après cette mise sur le marché, selon les lois sur les brevets et les règlements en vigueur.
Comme indiqué plus haut, pour déposer une opposition contre une déclaration de type IV, deux voies sont possibles, la voie judiciaire (devant la Cour de PI de Pékin) et la voie administrative (devant la CNIPA). La voie administrative est une procédure rapide, souvent utilisée pour les affaires simples. Pour les affaires compliquées et très litigieuses, en général, la voie administrative seule ne permet pas de résoudre le litige et la voie judiciaire sera préférée et permettra d’obtenir une décision de dernier recours. La voie judiciaire est donc considérée comme la dernière ligne de défense. Concernant l’articulation de ces procédures, relevons qu’une décision administrative ne sera rendue que si aucun dossier n’a été déposé auprès de la Cour alors qu’à l’inverse, même si une procédure administrative est en cours, la cour de PI pourra rendre une décision judiciaire.
Étant donné que le système du « patent linkage » a été établi récemment, des questions subsistent et leurs solutions nous apparaîtront au fur et à mesure dans la pratique. Par la mise en place de ce système, et en particulier la combinaison des deux voies, judiciaire et administrative, et l’équilibre des intérêts entre les fabricants de médicament original et de médicament générique, les autorités chinoises souhaitent encourager les innovations de médicament original tout en protégeant les droits légitimes des titulaires de brevet.
Article rédigé par , Mei TAO
