Voici un panorama de l’innovation pharmaceutique en Chine, stimulée par le gouvernement chinois qui favorise entre autres la mise sur le marché de nouveaux médicaments et leur protection par brevet.
Selon un rapport de l’institut Mc Kinsey d’octobre 2015 (The China effect on Global Innovation), la moitié des objectifs annuels de croissance du PIB de la Chine ne pourront être atteints que par l’innovation (soit 2 à 3% sur les 5,5 à 6,5% visés).
L’approche de la Chine a évolué de façon spectaculaire ces dernières années dans le domaine de l’innovation, puisque par exemple le pays est devenu le 4ème déposant de brevets en Europe, avec une entreprise chinoise se classant au 5ème rang des déposants ; le nombre de dépôts de demandes de brevet auprès de l’office chinois (SIPO) a également explosé, avec 928.000 dépôts de brevets en 2014, dont 13,7% en provenance de l’étranger. Cependant, la situation est contrastée selon le domaine technique, les plus forts progrès ont été enregistrés dans le numérique, l’informatique et les télécommunications.
Parmi les 4 grands modèles d’innovation identifiés par Mc Kinsey, celui pour lequel la science est le moteur principal (« science based » innovation), dont font partie la création de médicament et la pharmacie au sens large, ne parait pas encore aussi compétitif que les autres pour le moment en Chine. Néanmoins, le dynamisme de ce secteur et les mesures du gouvernement devraient faire rapidement évoluer la tendance.
Un prix Nobel de médecine en 2015
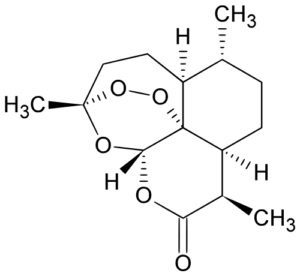
L’innovation dans ce domaine a des fondements historiques en Chine.
En octobre 2015, le Prix Nobel a récompensé les travaux de Tu Youyou, âgée aujourd’hui de 85 ans, pour la découverte d’un médicament contre le paludisme, l’artémisinine. Avec son équipe, de l’académie chinoise des sciences médicales, Tu Youyou a isolé le principe actif d’une plante utilisée dans la médecine traditionnelle chinoise, et l’a modifié pour supprimer sa toxicité, dès 1971, permettant à d’autres équipes de synthétiser une forme cristalline pure de la molécule.
Cependant, aucun brevet n’avait été déposé hors de Chine, et c’est principalement Novartis qui a finalement développé le médicament ; les entreprises chinoises, non retenues par l’OMS sur des critères qualitatifs, n’ont que très peu participé à cette commercialisation et à la valorisation de cette découverte majeure.
Des faiblesses qui sont sans doute dues à plusieurs causes, dont l’ancien modèle économique, et que le gouvernement chinois s’attache à corriger par des réformes d’envergure.
Un potentiel scientifique et humain considérable, et un programme d’améliorations encore en cours
Les universités et les organismes académiques financés par des fonds publics chinois sont autorisés depuis plusieurs années à déposer des demandes de brevet.
Dans son rapport 2014-2015 sur la coopération sur la PI entre les Etats-Unis et la Chine, la Chambre de Commerce américaine pointait des domaines d’amélioration pour dynamiser le potentiel d’innovation de la Chine dans le secteur pharmaceutique et la mise au point de nouvelles entités chimiques appelées à devenir les médicaments de demain :
- lien avec le statut des brevets correspondants lors de la procédure d’autorisation administrative du médicament : absent en Chine (à la différence par exemple des Etats-Unis) un tel système permettrait au titulaire du brevet d’agir en contrefaçon devant la CFDA (Chinese Food and Drug administration) avant la mise sur le marché d’un générique. Cela aiderait aussi le fabricant de génériques à déterminer si son produit contrefait un brevet en Chine,
- protection des données réglementaires : n’existant pas non plus en Chine, ce type de disposition interdit, pendant une période de temps définie, à un fabricant de génériques d’utiliser les données cliniques obtenues par l’innovateur ; les fabricants de génériques peuvent immédiatement utiliser ces données en Chine et bénéficier ainsi des investissements réalisés par l’innovateur pour mener les essais cliniques longs et coûteux.
Ce rapport de la Chambre de Commerce américaine souligne par ailleurs l’excellence scientifique reconnue des équipes chinoises, qui sont devenues des acteurs majeurs pour réaliser des recherches à façon (CRO ou « Contract Research Organisation »). Wuxi Apptec et Shanghai Zhangjiang Hightech Park sont cités comme des CRO de haute qualité dans le monde de l’industrie pharmaceutique.
Cette excellence scientifique est sans doute appelée à s’intensifier, avec le programme « Thousand Talents » initié par le gouvernement en 2008.
Ce programme vise à encourager les scientifiques chinois ayant fait leurs études et établis à l’étranger à revenir en Chine, en leur offrant des conditions de travail et de vie avantageuses. Il est à noter qu’il existe aussi un volet destiné aux scientifiques étrangers.
Brevetabilité dans le domaine pharmaceutique
La protection par brevet des inventions pharmaceutiques est garantie par la loi. Les Directives du SIPO autorisent, lors de l’examen de brevetabilité, la prise en compte de résultats expérimentaux fournis après le dépôt de la demande. C’est un point crucial pour la protection de l’innovation pharmaceutique, où la compétition ne permet pas d’attendre de disposer de l’ensemble des données (notamment cliniques) pour déposer un brevet.
Cependant, relevons que ces dispositions ne s’appliquent qu’aux données expérimentales visant à soutenir l’activité inventive. En outre, les exemples supplémentaires ne seront acceptés que s’ils sont associés à un effet technique explicitement mentionné et prouvé par quelques résultats expérimentaux existant déjà dans la description initiale. En pratique, l’acceptation de résultats complémentaires parait encore soumise à une interprétation restrictive des examinateurs.
Procédure d’autorisation des médicaments par la CFDA : une réforme qui répond à une attente forte des entreprises
Une autre mesure phare adoptée récemment concerne la procédure d’autorisation de mise sur le marché des médicaments et des dispositifs médicaux ; la CFDA a annoncé, en aout 2015, plusieurs modifications visant à désengorger l’administration qui a pris beaucoup de retard et à diminuer les délais de traitement des dossiers.
La circulaire n°230 de novembre 2015 révèle les principales directives pour sa mise en œuvre, à compter du 1er décembre 2015, qui porte sur les points suivants (selon l’analyse de Ropes & Gray) :
- extension de la procédure accélérée de délivrance à de nouvelles catégories de médicaments, comme les médicaments infantiles, les médicaments innovants étrangers fabriqués en Chine, ou ceux pour lesquels un examen est également en cours pour l’obtention d’une AMM aux USA ou en Europe ;
- modification du système du détenteur de l’AMM. Un programme pilote de 3 ans va être mené dans 10 provinces ;
- changement de la classification pour les nouveaux médicaments ou les génériques, pour lesquels les définitions seront très différentes de celles précédemment en vigueur à la CFDA ;
- simplification de la procédure d’approbation pour les essais cliniques. La CFDA désignera une plateforme pour enregistrer les études de bioéquivalence.
Les sociétés chinoises en marche
Relevons que des entreprises nationales se sont déjà appuyées sur les spécificités de la Chine pour prendre des positions fortes dans le domaine de la pharmacie ou des biotechnologies.
BeiGene a reçu le prix BayHelix 2015 pour le développement d’anticorps et de traitements biotechnologiques du cancer, dont certains ont reçu l’approbation de la FDA. L’entreprise a accéléré son processus de drug discovery en déployant une équipe d’évaluation de médicament à grande échelle, en testant les composés sur des tissus humains pendant la phase clinique précoce pour avoir rapidement une information sur les questions pouvant se poser lors des essais chez l’humain et en capitalisant sur l’accès au large réservoir chinois de patients.
BGI, une autre société chinoise du secteur de la génomique, s’est déployé à une échelle massive (2 000 PhD et plus de 200 machines à séquençage) pour résoudre les problèmes dans le domaine des biotechnologies.
Les initiatives fortes du gouvernement chinois pour stimuler l’innovation et favoriser la mise sur le marché de nouveaux médicaments doivent être prises en compte par les entreprises pharmaceutiques internationales pour adapter leur stratégie de développement à ce nouvel environnement. La démographie chinoise et l’accès croissant aux soins de la population chinoise devrait assurer une progression dans ce domaine, même si le taux de croissance du pays ne sera peut-être pas celui initialement escompté.
Article rédigé par Myriam ALLAB
